Dalam percobaan qPCR, desain primer juga merupakan tautan yang sangat penting.Apakah primer cocok atau tidak terkait erat dengan apakah efisiensi amplifikasi mencapai standar, apakah produk yang diamplifikasi spesifik, dan apakah hasil eksperimen tersedia.
Jadi bagaimana membuat kekhususan primer qPCR menjadi lebih baik?Efisiensi amplifikasi tinggi?
Hari ini, kami akan mengajak Anda untuk merancang primer qPCR bersama-sama, dan biarkan desain primer qPCR menjadi keterampilan pengetahuan yang efisien dalam eksperimen.
Saat mendesain primer qPCR, biasanya perhatikan hal-hal berikut: primer harus dirancang melintasi intron sebanyak mungkin, panjang produk harus 100-300 bp, nilai Tm harus sedekat mungkin dengan 60°C, dan primer upstream dan downstream harus sedekat mungkin, dan ujung primer harus G atau C, dll. tunggu.
1. Desain primer yang mencakup intron
Saat mendesain primer qPCR, memilih primer yang dirancang lintas intron dapat mencegah template gDNA diamplifikasi, dan produk semuanya berasal dari amplifikasi cDNA, sehingga menghilangkan pengaruh kontaminasi gDNA.
2. Panjang primer
Panjang primer umumnya antara 18-30 nt, dan panjang produk amplifikasi harus dikontrol sebanyak mungkin antara 100-300 bp.
Jika primer terlalu pendek akan menyebabkan amplifikasi non-spesifik, dan jika terlalu panjang akan mudah membentuk struktur sekunder (seperti struktur jepit rambut).Jika produk amplifikasi terlalu lama, tidak cocok untuk reaksi polimerase, yang akan mempengaruhi efisiensi amplifikasi PCR.
3. Konten GC dan nilai Tm
Kandungan GC primer harus dikontrol antara 40% dan 60%.Jika terlalu tinggi atau terlalu rendah, tidak kondusif untuk memulai reaksi.Kandungan GC primer maju dan mundur harus mendekati sama untuk mendapatkan nilai Tm dan suhu anil yang sama.
Nilai Tm harus sejauh mungkin antara 55-65°C, umumnya sekitar 60°C, dan nilai Tm hulu dan hilir harus sedekat mungkin, sebaiknya tidak lebih dari 4°C.
4. Hindari memilih A pada ujung 3′ primer
Ketika ujung 3' primer tidak cocok, ada perbedaan besar dalam efisiensi sintesis basa yang berbeda.Ketika basis terakhir adalah A, itu juga dapat memulai sintesis rantai bahkan dalam kasus ketidakcocokan, dan ketika basis terakhir adalah T Ketika, efisiensi induksi ketidakcocokan sangat berkurang.Oleh karena itu, cobalah untuk menghindari memilih A pada ujung 3′ primer, dan lebih baik memilih T.
Jika itu adalah probe primer, ujung 5′ dari probe tidak boleh G, karena bahkan ketika basis G tunggal terhubung ke grup reporter fluoresen FAM, G juga dapat memadamkan sinyal fluoresen yang dipancarkan oleh grup FAM, menghasilkan hasil negatif palsu.Muncul.
5. Distribusi basis
Distribusi keempat basa dalam primer lebih disukai acak, menghindari lebih dari 3 G atau C berturut-turut pada ujung 3′, dan lebih dari 3 basa berturut-turut.G atau C mudah dibuat berpasangan di wilayah urutan kaya GC.
6. Daerah desain primer harus menghindari struktur sekunder yang kompleks.
Struktur sekunder yang dibentuk oleh untai tunggal produk amplifikasi akan mempengaruhi kelancaran proses PCR.Dengan memprediksi terlebih dahulu apakah ada struktur sekunder dalam urutan target, cobalah untuk menghindari wilayah ini dalam desain primer.
7. Primer itu sendiri dan di antara primer harus berusaha menghindari basa pelengkap yang berurutan.
Tidak boleh ada komplementaritas 4 basis berturut-turut antara primer itu sendiri dan primer.Primer itu sendiri seharusnya tidak memiliki urutan komplementer, jika tidak maka akan terlipat sendiri untuk membentuk struktur jepit rambut, yang akan mempengaruhi kombinasi anil primer dan template.
Urutan pelengkap tidak dapat ada antara primer hulu dan hilir.Komplementaritas antar primer akan menghasilkan dimer primer yang akan menurunkan efisiensi PCR bahkan mempengaruhi akurasi kuantitatif.Jika struktur primer-dimer dan hairpin tidak dapat dihindari, nilai △G tidak boleh terlalu tinggi (harus kurang dari 4,5 kkal/mol).
8. Primer memperkuat produk spesifik target.
Tujuan akhir dari deteksi qPCR adalah untuk memahami kelimpahan gen target.Jika amplifikasi non-spesifik terjadi, kuantifikasi akan menjadi tidak akurat.Oleh karena itu, setelah primer dirancang, mereka perlu diuji dengan BLAST, dan spesifisitas produk dibandingkan dalam database urutan.
Selanjutnya, kami mengambil gen manusia GAS6 (Growth arrest specific 6) sebagai contoh untuk merancang primer qPCR.
01 permintaan gen
Homo GAS6melalui NCBI.Di sini, kita harus memperhatikan untuk membandingkan nama gen dan spesies untuk memastikan bahwa keduanya konsisten.
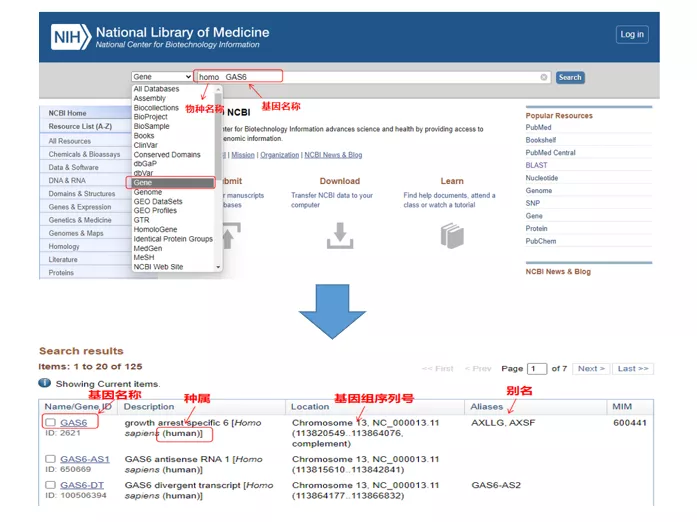 02 Temukan urutan gen
02 Temukan urutan gen
(1) Jika sekuens target adalah DNA genomik, pilih yang pertama, yaitu sekuens DNA genomik dari gen tersebut.
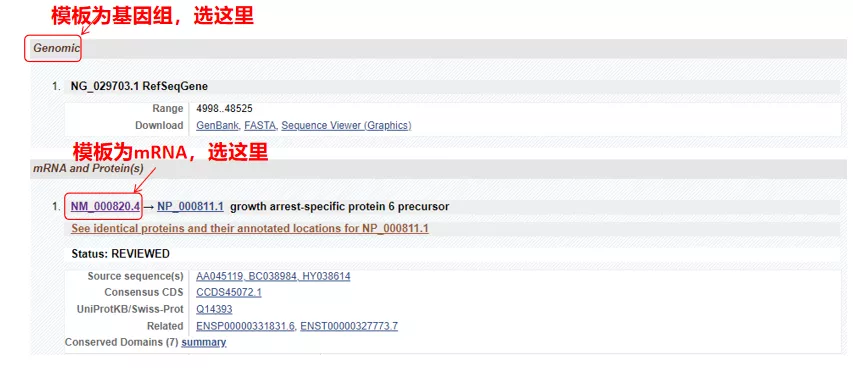 (2) Jika urutan target adalah mRNA, pilih yang kedua.Setelah masuk, klik “CDS” pada tabel di bawah ini.Urutan latar belakang coklat adalah urutan pengkodean gen.
(2) Jika urutan target adalah mRNA, pilih yang kedua.Setelah masuk, klik “CDS” pada tabel di bawah ini.Urutan latar belakang coklat adalah urutan pengkodean gen.
 03 Primer desain
03 Primer desain
Masuk ke antarmuka Primer-BLAST
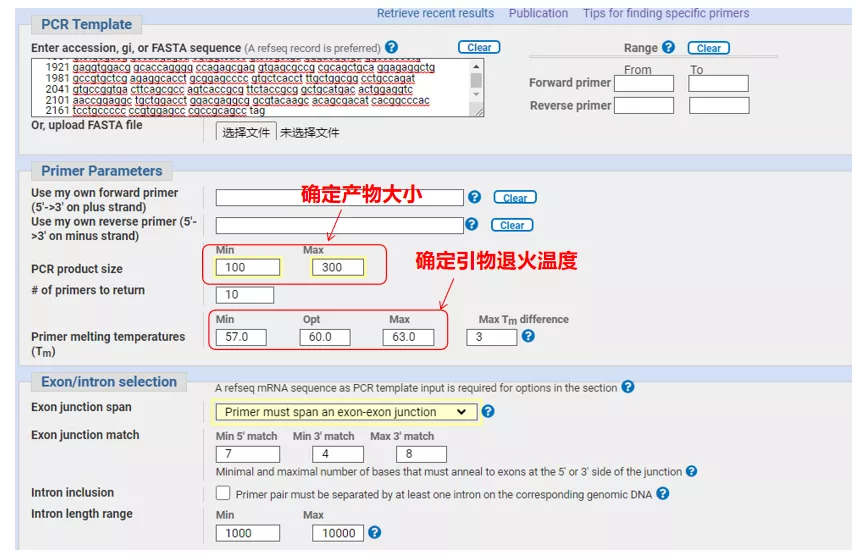
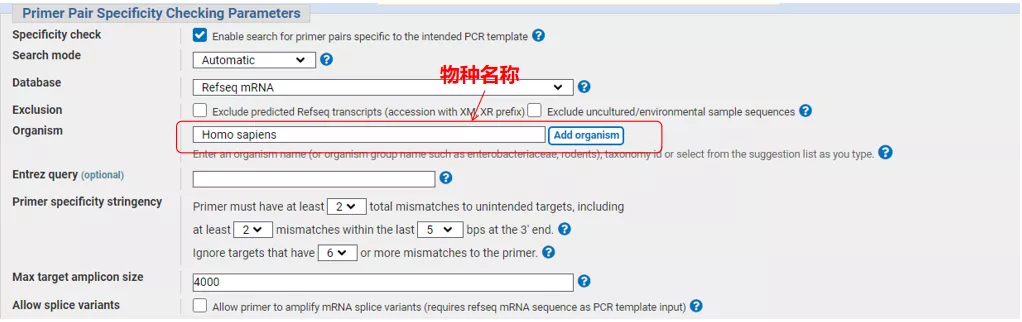
 Masukkan nomor urut gen atau urutan dalam format Fasta di kiri atas, dan isi parameter yang relevan.
Masukkan nomor urut gen atau urutan dalam format Fasta di kiri atas, dan isi parameter yang relevan.
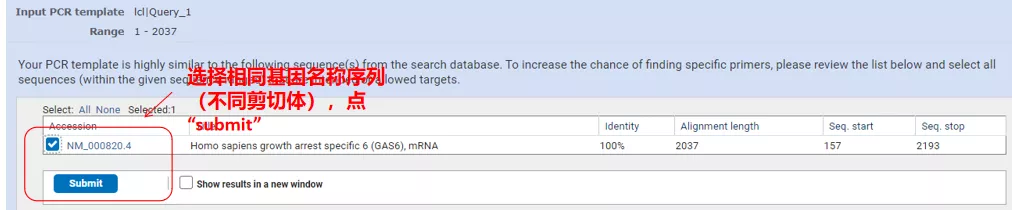
Klik "Dapatkan primer" dan NCBI akan muncul untuk memberi tahu Anda bahwa pemilihan parameter tersebut akan diperkuat ke varian splicing lainnya.Kami dapat memeriksa varian penyambungan yang berbeda dan mengirimkannya untuk mendapatkan pasangan primer yang sesuai (seperti yang ditunjukkan pada gambar di bawah).Proses ini mungkin memakan waktu puluhan detik untuk dijalankan.
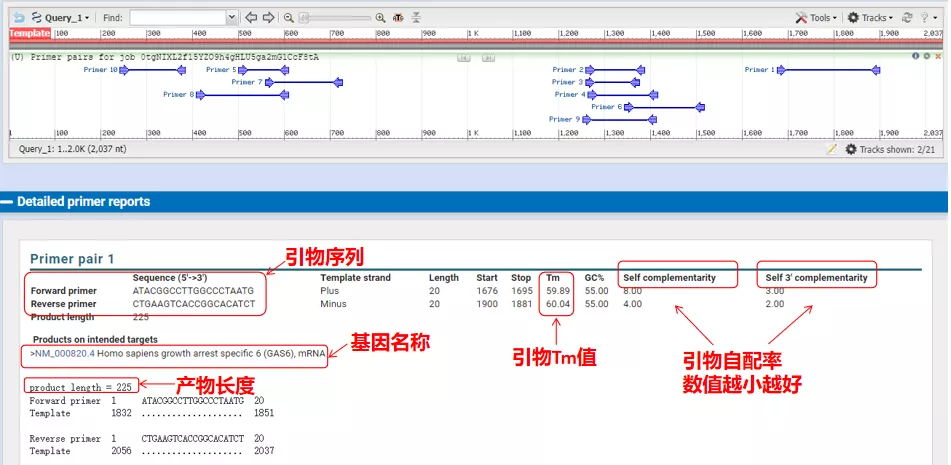 Suhu anil dari pasangan primer ini sekitar 60°C.Sesuai dengan tujuan percobaan, pilihlah primer dengan panjang sedang, spesifisitas yang baik, dan pelengkap primer yang kurang untuk percobaan, dan tingkat keberhasilannya cukup tinggi!
Suhu anil dari pasangan primer ini sekitar 60°C.Sesuai dengan tujuan percobaan, pilihlah primer dengan panjang sedang, spesifisitas yang baik, dan pelengkap primer yang kurang untuk percobaan, dan tingkat keberhasilannya cukup tinggi!
04Verifikasi spesifisitas primer
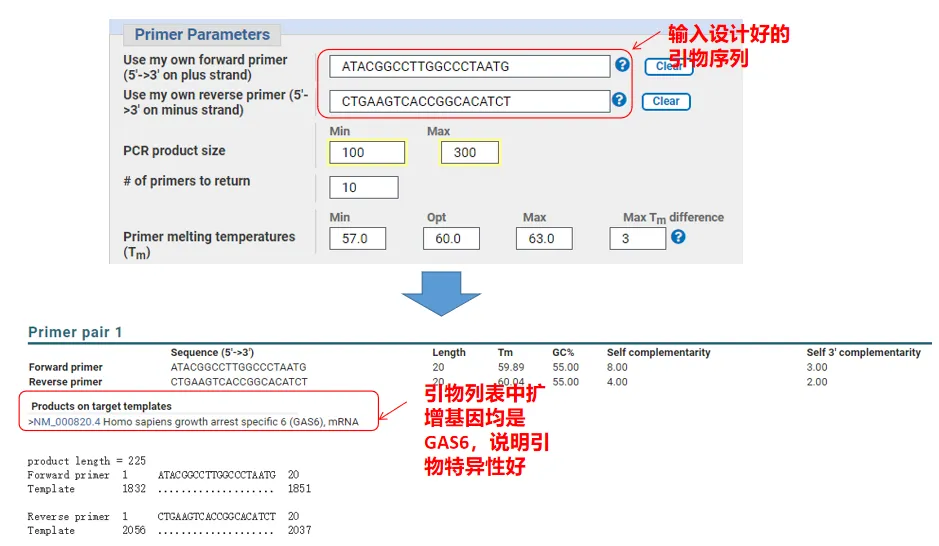
Padahal, selain mendesain primer, Primer-Blast juga bisa mengevaluasi primer yang kita desain sendiri.Kembali ke halaman desain primer, masukkan primer hulu dan hilir yang kami rancang, dan parameter lain tidak akan disesuaikan.Setelah dikirimkan, Anda dapat melihat apakah pasangan primer juga ada pada gen lain.Jika semuanya ditampilkan pada gen yang ingin kita perkuat , menunjukkan bahwa spesifisitas pasangan primer ini sangat bagus!(Misalnya, ini adalah satu-satunya hasil kueri primer!)
05 Penilaian kualitas primer
Jenis primer apa yang merupakan primer "sempurna" yang menggabungkan "efisiensi amplifikasi hingga standar", "karakteristik produk yang diperkuat", dan "hasil eksperimen yang andal"?
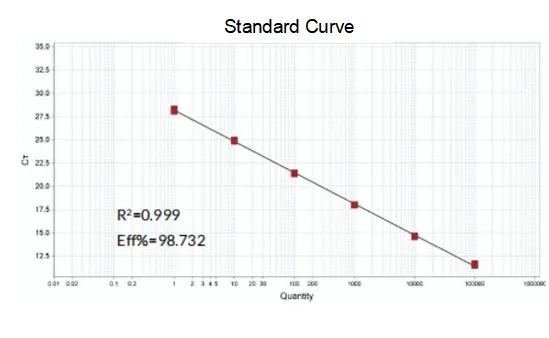 Efisiensi amplifikasi
Efisiensi amplifikasi
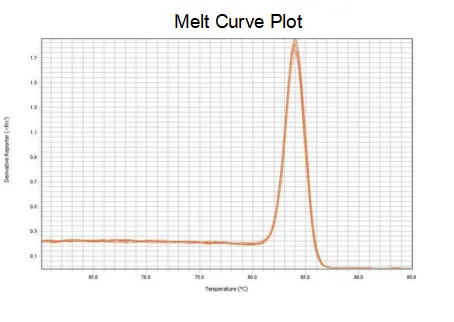 kurva leleh
kurva leleh
Efisiensi amplifikasi primer mencapai 90%-110%, yang berarti efisiensi amplifikasi baik, dan kurva leleh memiliki puncak tunggal dan biasanya Tm>80°C, yang berarti spesifisitas amplifikasi baik.
Produk-produk terkait:
PCR Waktu Nyata Mudah–SYBR GREEN I
PCR Waktu Nyata Mudah-Taqman
Waktu posting: Feb-10-2023








