Ringkasan
Identifikasi cepat tanaman transgenik
Teks/Tong Yucheng
Operasi eksperimental/Han Ying
Editor/Wen Youjun
Kata/1600+
Waktu membaca yang disarankan/8-10 menit
Identifikasi cepat tanaman transgenik
Sebagai pendatang baru di laboratorium, bukanlah pekerjaan yang baik untuk menyaring tanaman positif dari sekelompok tanaman dengan tingkat konversi yang rendah.Pertama, DNA harus diekstraksi dari sejumlah besar sampel satu per satu, dan kemudian gen asing akan terdeteksi oleh PCR.Namun, hasilnya seringkali kosong dan pita dengan beberapa item kadang-kadang, tetapi tidak mungkin untuk menentukan apakah ada deteksi yang salah atau deteksi yang salah..Apakah sangat tidak berdaya menghadapi proses dan hasil percobaan seperti itu?Jangan khawatir, abang ajari cara menyaring tanaman positif transgenik dengan mudah dan akurat.
Langkah 1: Primer deteksi desain
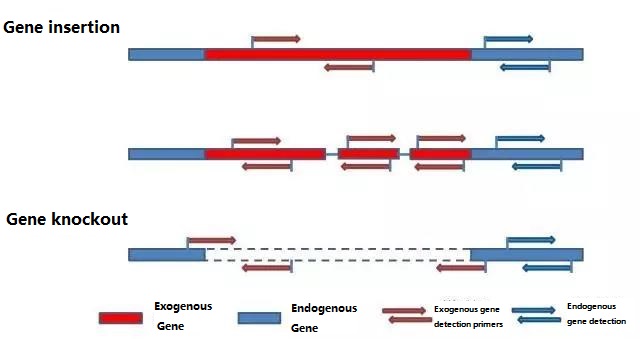
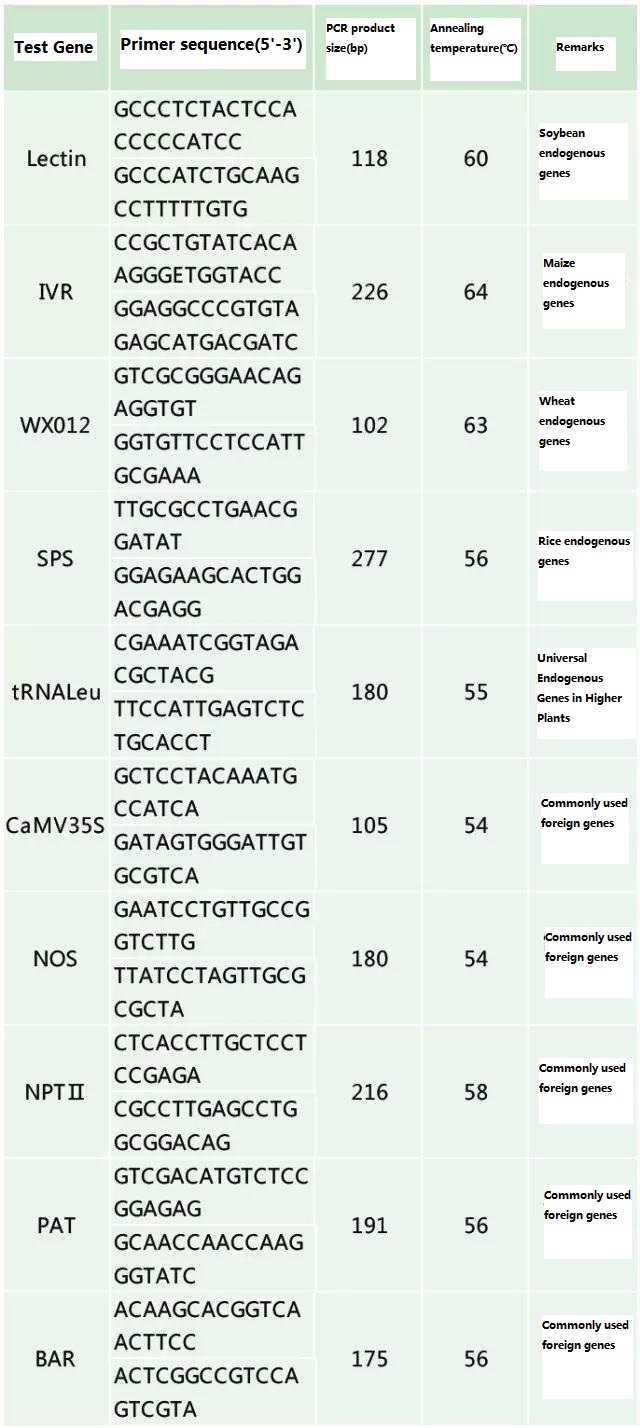
Tentukan gen endogen dan gen eksogen yang akan dideteksi sesuai dengan sampel yang akan diuji, dan pilih urutan 100-500bp yang representatif dalam gen untuk desain primer.Primer yang baik dapat memastikan keakuratan hasil deteksi dan mempersingkat waktu deteksi (lihat lampiran untuk primer deteksi yang umum digunakan).
Catatan:
Primer yang baru dirancang perlu mengoptimalkan kondisi reaksi dan memverifikasi akurasi, presisi, dan batas deteksi sebelum melakukan deteksi skala besar.
Langkah 2:Mengembangkan protokol eksperimental

Kontrol positif: Gunakan DNA murni yang mengandung fragmen target sebagai templat untuk menentukan apakah sistem dan kondisi reaksi PCR normal.
Kontrol negatif/kosong: Gunakan templat DNA atau ddH2O yang tidak mengandung target fragment sebagai template untuk mendeteksi apakah ada sumber kontaminasi pada sistem PCR.
Kontrol referensi internal: gunakan kombinasi primer/probe dari gen endogen sampel yang akan diuji untuk mengevaluasi apakah templat dapat dideteksi oleh PCR.
Catatan:
Kontrol positif, negatif/kosong dan kontrol kontrol internal harus ditetapkan untuk setiap pengujian guna mengevaluasi validitas hasil eksperimen.
Langkah3: Persiapan percobaan

Sebelum digunakan, amati apakah larutan tercampur rata.Jika presipitasi ditemukan, perlu dilarutkan dan dicampur sesuai petunjuk sebelum digunakan.Campuran 2×PCR perlu dipipet dan dicampur berulang kali dengan mikropipet sebelum digunakan untuk menghindari distribusi ion yang tidak merata.
Catatan:
Keluarkan instruksi dan baca dengan seksama, dan buat persiapan sebelum percobaan sesuai dengan instruksi.
Langkah 4: Siapkan sistem reaksi PCR
Menurut protokol eksperimental, campurkan primer, H2O, 2×PCR campurkan, centrifuge dan distribusikan ke masing-masing tabung reaksi.
Catatan:
Untuk pengujian skala besar atau jangka panjang, disarankan untuk menggunakan sistem reaksi PCR yang mengandung enzim UNG, yang secara efektif dapat menghindari kontaminasi aerosol yang disebabkan oleh produk PCR.
Langkah 5: Tambahkan templat reaksi

Dengan menggunakan teknologi Direct PCR, tidak diperlukan proses pemurnian asam nukleat yang membosankan.Templat sampel dapat disiapkan dalam waktu 10 menit dan ditambahkan ke sistem reaksi PCR yang sesuai.
Catatan:
Metode Lisis memiliki efek deteksi yang lebih baik, dan produk yang diperoleh dapat digunakan untuk beberapa reaksi deteksi.
5.1: PCR langsung daun
Sesuai dengan ukuran gambar di manual, potong jaringan daun dengan diameter 2-3mm dan letakkan di sistem reaksi PCR.
Catatan: Pastikan potongan daun benar-benar terendam dalam larutan reaksi PCR, dan jangan menambahkan jaringan daun secara berlebihan.
5.2: Metode lisis daun
Potong jaringan daun dengan diameter 5-7mm dan masukkan ke dalam tabung sentrifus.Jika Anda memilih daun dewasa, harap hindari menggunakan jaringan urat utama daun.Pipet 50ul Buffer P1 lisat ke dalam tabung centrifuge untuk memastikan bahwa lisat benar-benar dapat merendam jaringan daun, tempatkan dalam thermal cycler atau metal bath, dan lyse pada suhu 95°C selama 5-10 menit.


Tambahkan larutan netralisasi 50ul Buffer P2 dan aduk rata.Lisat yang dihasilkan dapat digunakan sebagai templat dan ditambahkan ke sistem reaksi PCR.
Catatan: Jumlah templat harus antara 5-10% dari sistem PCR, dan tidak boleh melebihi 20% (misalnya, dalam sistem PCR 20μl, tambahkan 1-2μl buffer lisis, tidak lebih dari 4μl).
Langkah 6: Reaksi PCR

Setelah tabung reaksi PCR disentrifugasi, masukkan ke dalam instrumen PCR untuk amplifikasi.
Catatan:
Reaksi tersebut menggunakan template non-purified untuk amplifikasi, sehingga jumlah siklus amplifikasi 5-10 siklus lebih banyak dibandingkan dengan menggunakan template DNA murni.
Langkah 7: Deteksi elektroforesis dan analisis hasil

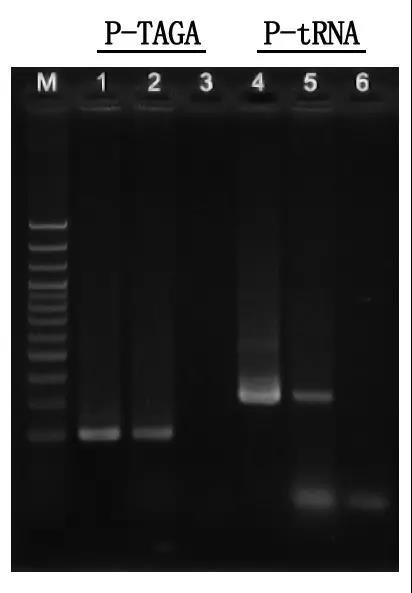
Tangga DNA M:100bp
1\4: Metode DNA murni
2\5: Metode PCR langsung
3\6: Kontrol kosong
Kontrol kualitas:
Hasil pengujian berbagai kontrol yang ditetapkan dalam percobaan harus memenuhi ketentuan berikut.Jika tidak, penyebab masalah harus dianalisis, dan pengujian harus dilakukan lagi setelah masalah dihilangkan.
Tabel 1. Hasil uji normal berbagai kelompok kontrol

*Ketika plasmid digunakan sebagai kontrol positif, hasil tes gen endogen bisa negatif
Penilaian hasil:
A. Hasil uji gen endogen sampel negatif, menunjukkan bahwa DNA yang cocok untuk deteksi PCR biasa tidak dapat diekstraksi dari sampel atau DNA yang diekstraksi mengandung penghambat reaksi PCR, dan DNA harus diekstraksi lagi.
B. Hasil uji gen endogen sampel positif, dan hasil uji gen eksogen negatif, menunjukkan bahwa DNA yang cocok untuk deteksi PCR biasa diekstraksi dari sampel, dan dapat dinilai bahwa gen XXX tidak terdeteksi dalam sampel.
C. Hasil uji gen endogen sampel positif, dan hasil uji gen eksogen positif, menunjukkan bahwa DNA yang cocok untuk deteksi PCR biasa telah diekstraksi dari sampel, dan DNA sampel mengandung gen XXX.Eksperimen konfirmasi dapat dilakukan lebih lanjut.
Langkah 8: Rancang primer deteksi

Setelah percobaan, gunakan larutan natrium hipoklorit 2% dan larutan etanol 70% untuk menyeka area percobaan untuk mencegah pencemaran lingkungan.
Lampiran
Tabel 2. Primer yang biasa digunakan untuk deteksi PCR umum tanaman rekayasa genetika
Dokumen referensi:
SN/T 1202-2010, Metode deteksi PCR kualitatif terhadap bahan tumbuhan hasil rekayasa genetika dalam pangan.
Pengumuman Kementerian Pertanian 1485-5-2010, Pengujian bahan tanaman rekayasa genetika dan produknya-beras M12 dan turunannya.
Waktu posting: Jun-09-2021








